题目:Defining cellular population dynamics at single-cell resolution during prostate cancer progression
期刊 | 日期 :eLife | November 2022
DOI:https://doi.org/10.7554/eLife.79076
0、简介
本文设计了多种精细的前列腺癌小鼠模型,结合单细胞测序数据进行了深入的探索,例如前列腺癌特异相关的细胞类型,免疫特征以及Castration处理前后的多角度分析。这为理解前列腺癌的发生以及castration resistant的机制以及治疗措施提出了新的见解与观点。
- 数据集已上传到:GSE171336
- 数据图谱已制作成交互式网页,方便查询:https://atlas.fredhutch.org/hsieh-prostate/
此外,这篇文章的数据量、工作量较为丰富,差异分析、轨迹推断、细胞通讯分析策略值得精读、学习。原文也提供了部分分析与绘图代码:https://github.com/sonali-bioc/GermanosProstatescRNASeq/
1、前列腺癌模型小鼠单细胞图谱
(1)测序数据
- 3只对照组6月龄小鼠(WT)与2只前列腺癌模型6月龄小鼠(Pten)
Pten模型组:对小鼠前列腺的基底(Basal)与管腔(Luminal)上皮细胞的肿瘤抑制基因Pten的5号外显子进行敲除。之后笔记简称Pten组
(2)使用SingleR软件注释出3大类细胞:epithelial,stromal以及immune cells
(3)结合文献marker,进一步注释两组的上皮细胞亚型
- 对WT组释出basal(Krt5/Sox4), luminal differentiated(Nkx3-1/Sbp)以及luminal progenitor(Psca/Tactsd/Krt4)与Urethral(Aqp3/Ly6d)
- 对Pten上皮细胞进一步注释出basal,Urethral,luminal differentiated,以及一种intermediate luminal(Krt4/Tacstd2/Ppp1r1b,对应WT组的luminal progenitor)
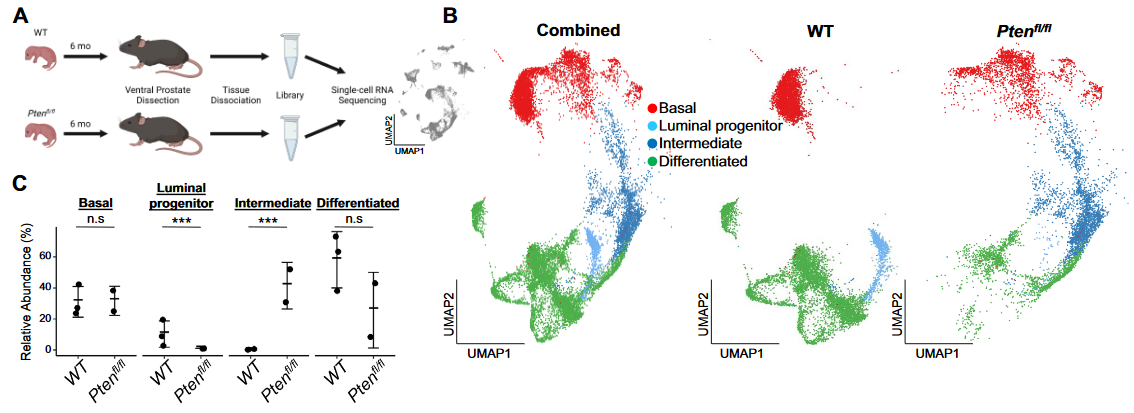
2、intermediate luminal细胞发育推断分析
(1)首先观察到Pten组的intermediate比例显著高于WT组的progenitor比例;
(2)Pten与WT组的同种细胞类型差异基因多富集在肿瘤发生、上皮细胞迁移增殖等通路;
(3)结合细胞周期分析在Pten组的basal细胞发现两种处于不同增殖状态的亚群
- hyper-proliferative,亚群占18.6%,其中99.7%的细胞处于G2/M、S,显著高于WT的basal
- hypo-proliferative,亚群81.4%,其中52.2%的细胞处于G2/M,S;显著低于WT的basal
(4)上述两个亚群间差异分析
- hypo-proliferative富集在迁移、发育分化通路
- hyper-proliferative富集在细胞周期相关通路
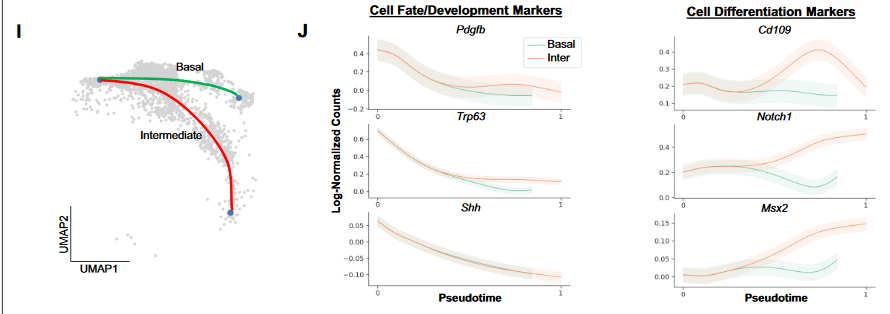
(5)结合Monocle3、RNA velocity、Palantir推断出由hypo-proliferative到intermediate luminal的发育轨迹以及相关基因;
(6)基于luminal的maker基因表达,发现intermediate luminal也有可能源自luminal progenitor发育而来。
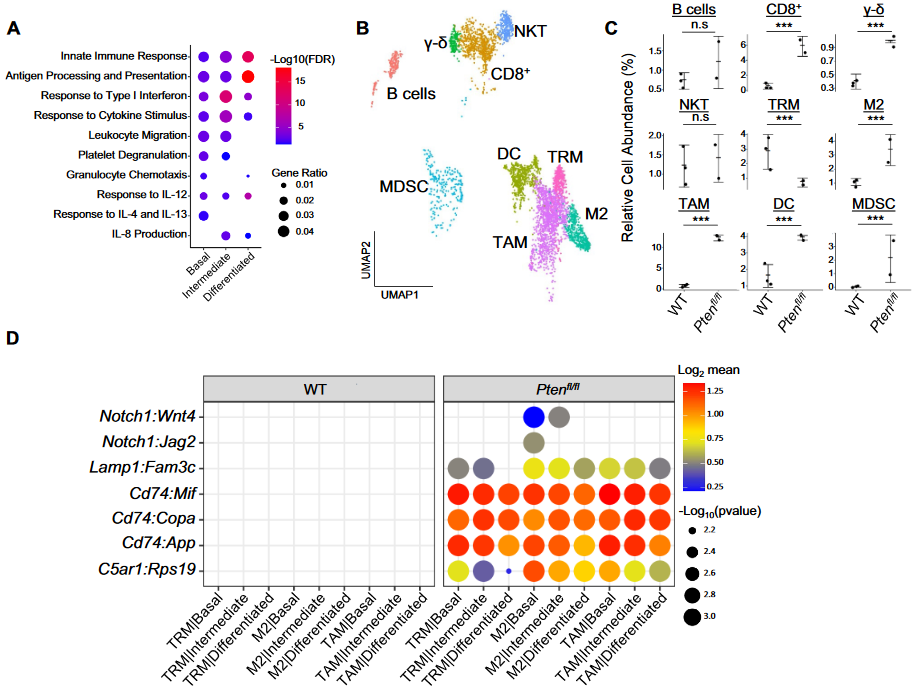
3 前列腺癌模型小鼠的免疫细胞特征
(1)首先观察到Pten与WT组的同种细胞类型差异基因也富集到免疫相关通路;
(2)对免疫细胞进行亚型注释如下
- neutrophil → myeloid-derived suppressor cells (MDSCs)
- macrophage → TAM,M2,TRM(tissue-resident)
- T cell → CD8+,gamma-delta T, NKT
- B cell, DC细胞
(3)除B,TRM,NKT细胞外,其它细胞类型比例Pten组显著高于WT组,其中M2、TAM、MDSCs以及CD8+ T均具有促进肿瘤作用。
(3)使用CellPhoneDB分析上皮细胞等与免疫细胞之间的配受体通讯在Pten/WT差异表达,推断M2巨噬细胞由上皮与成纤维细胞招募,进而促进MDSCs与CD8+
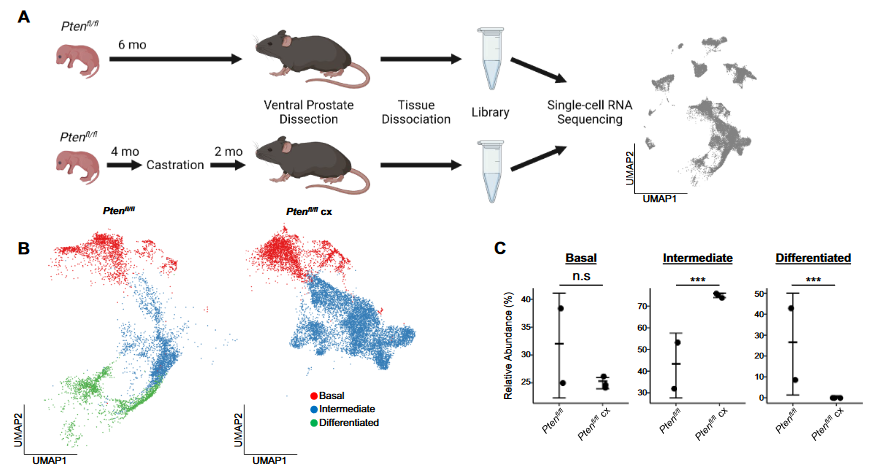
4、Castration引发intermediate luminal的异质性
(1)加入新的单细胞测序数据:
- 3只Pten组小鼠于4月龄时进行Castration阉割处理,待6月时取样测序
- 后续简称Pten cx组
(2)Pten cx组的intermediate luminal细胞比例显著扩增, 而没有differentiated luminal cells
(3)Pten组与Pten cx组的AR基因集得分均低于WT组的luminal progenitor
(4)对Pten与Pten cx组的intermediate细胞进行重聚类,共得到6个亚群
- C3主要来自Pten组
- C3高表达AR相关基因,靠近differentiated luminal
- C0、1、2、4主要来自Pten cx组
- C1表达basal相关基因,靠近basal
- C1与C4高表达翻译与增殖相关基因
- 6个亚群的AR分数与增殖翻译与增殖分数呈负相关
(5)加入新的单细胞测序数据
- 3只Castration处理的WT小鼠取样测序
- 后续简称WT cx
(6)WT cx的luminal类似Pten cx的intermediate高表达翻译相关基因,但是低表达增殖相关基因,表明可能与Pten相关
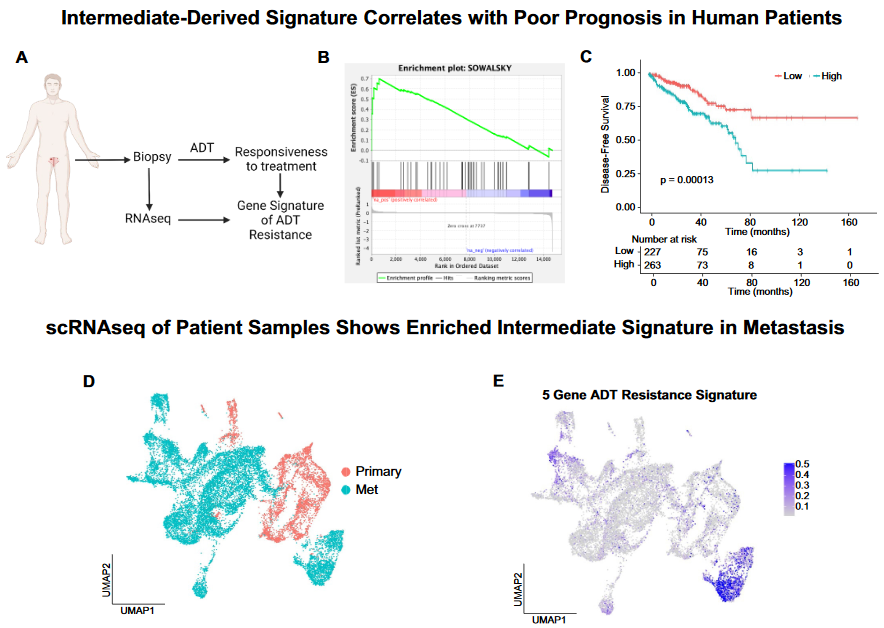
5、Castration intermediate cell预后signature
(1)基于人类前列腺癌数据定义androgen deprivation therapy(ADT) resistance相关基因集
(2)Pten与Pten cx的intermediate cell差异基因GSEA分析显著富集上述基因集
(3)上述基因集相关的Top 5 上调基因(Pten cx)包括ATP1B1、BST2、CP、IGFBP3、PTTG1,经深入分析具有如下特征:
- 在Pten组的intermediate亚群均低表达
- 在resistance to ADT的human tumor样本中显著高表达
- 这些基因的(任一)高表达与较差的预后相关
- 这些基因在人类转移性前列腺癌中高表达
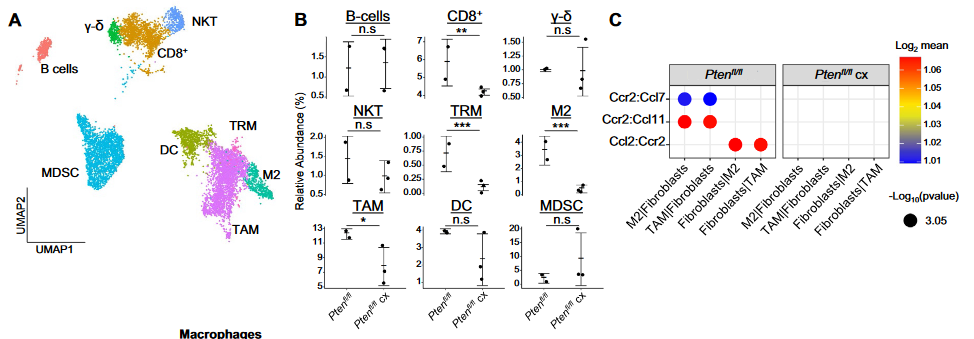
6、Castration引发的免疫细胞变化
(1)相比Pten组,Pten cx组的3种巨噬细胞以及CD8+ T比例均显著下降;
(2)结合Pten cx组低表达的配受体通讯,分析上述比例下降的原因;
(3)TNF的配受体细胞通讯在Pten CX组中特异性高表达。
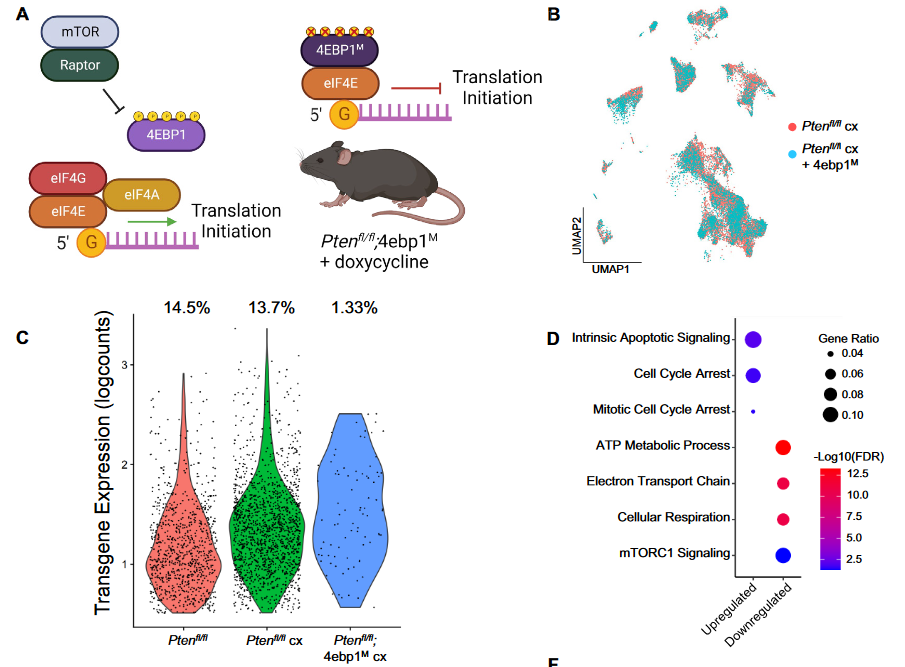
7、抑制翻译对Castration的杀伤作用
(1)加入新的单细胞测序数据
- Pten小鼠在4月龄经doxycycline(抑制翻译)给药与castration处理,待6月取样测序
- 后续简称Pten cx 4ebp1
(2)Pten cx 4ebp1与Pten cx的上皮细胞比例与分布无明显差异;
(3)transgene-positive的Pten cx 4ebp1与Pten cx的basal差异分析发现465个差异基因,进一步分析上调(细胞周期阻滞,细胞凋亡)、下调通路
(4)与Pten cs相比,Pten cx 4ebp1显著差异的配受体通讯(Tnf, Egfr)