AD星形胶质细胞与小胶质细胞的snRNA-seq数据分析
Diverse human astrocyte and microglial transcriptional responses to Alzheimer’s pathology
Acta Neuropathologica (2022) 143:75–91
IF=17
1、测序样本
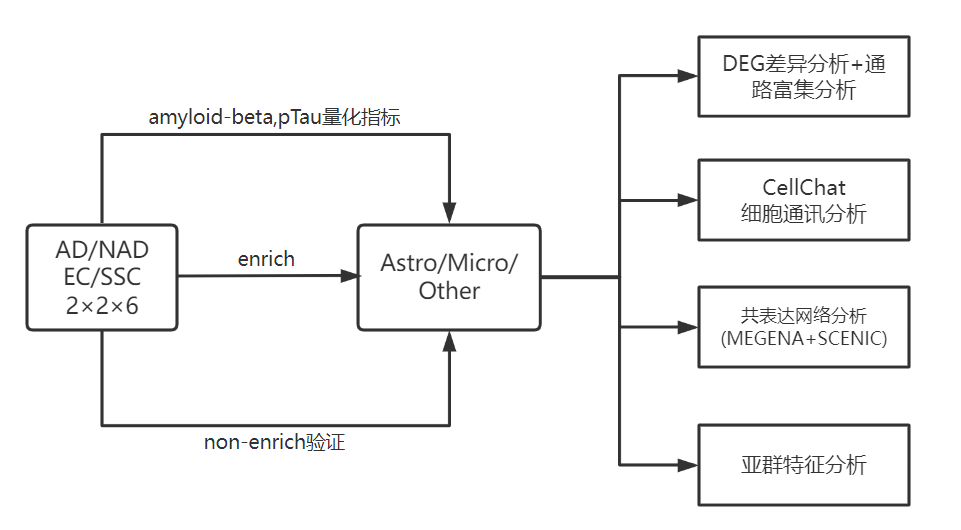
- 24个样本:AD与NDC的EC(entorhinal)与SSC(somatosensory) cortical region(2×2×6)
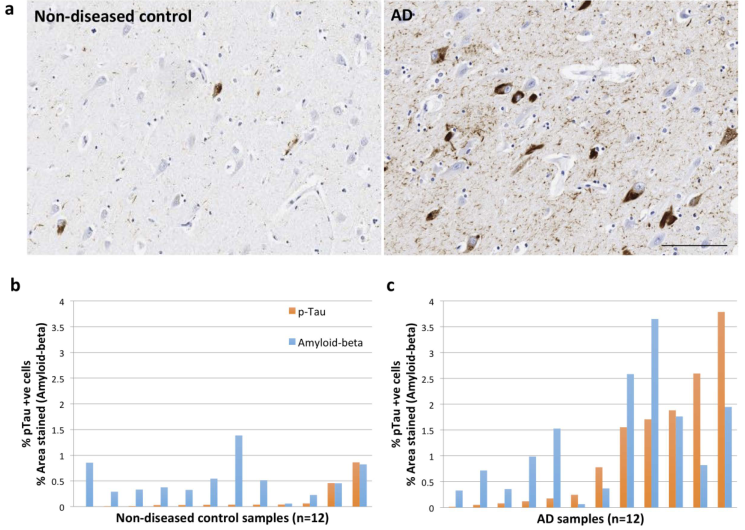
- 使用Immunohistochemistry量化每个样本的p-Tau与Amyloid-beta指标
- 本文是想研究astrocyte星形胶质细胞与microglial小胶质细胞在AD中所发挥的作用。但是The proportions of microglia and astrocytes defined by snR- NASeq of nuclei isolated from the human brain post-mortem are low and variable。
- 因此本文采取的方式是使用阴性选择方法去除样本中的neuron与oligodendroglia,间接富集Astro与Micro,再进行snRNA-seq测序。测序数据已经上传到GSE160936。
2、鉴定细胞类型
-
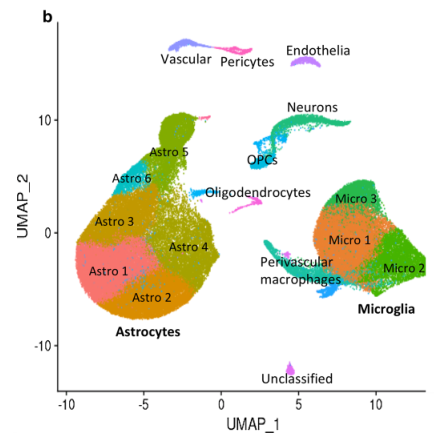
经数据预处理后,使用AUCell,结合细胞marker基因进行细胞类型注释,如下图所示Astro(52706)与Micro(27592)占大部分
-
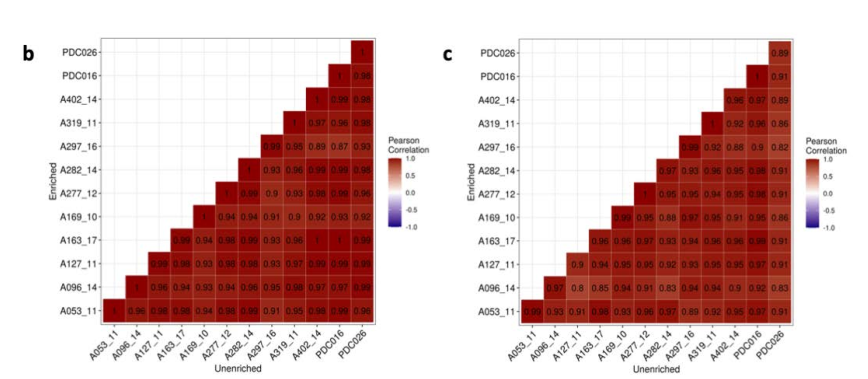
文章为了验证所富集的Astro与Micro不存在偏差bias,做了进一步的分析。即对上述24个样本又做了非富集的snRNAseq测序,注释出细胞类型。通过比较同一样本的富集与非富集的Astro(Micro)细胞类型的Top10% HVG高变基因的相关性,从而表示富集到Astro(Micro)不存在bias。
24+24=48个snRNAseq,这篇文章应该花了很多钱。
3、差异基因分析
-
文章并非按一般的AD/NAD差异分析,而是将基因表达与样本的p-Tau(或Amyloid-beta)指标进行回归分析,并校正性别、线粒体含量等因素。
-
此时基因差异表达倍数的含义表示为pTau (or amyloid density)发生一单位的变化,基因表达差异的log2倍数(斜率)。如下例图所示
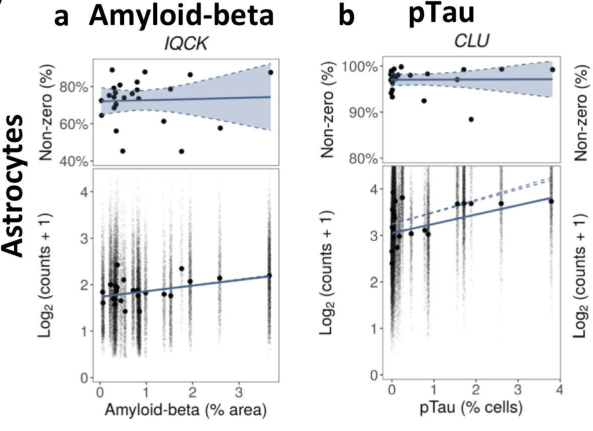
文章提到是使用MAST包的zlm()进行的回归分析。
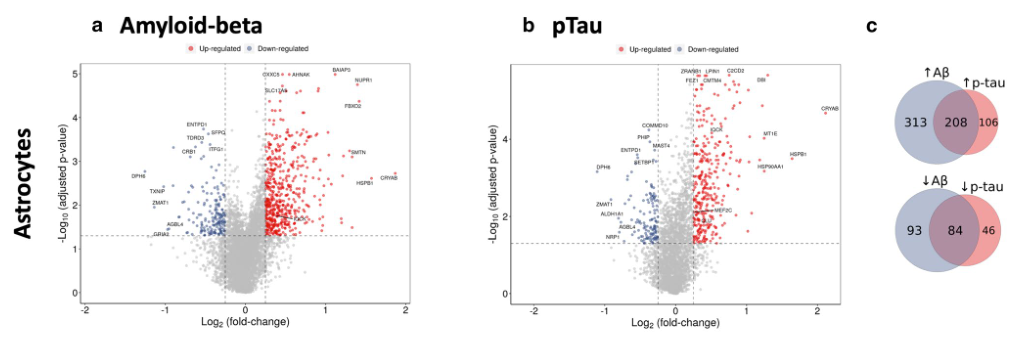
- 按照上述思路可分别对Astro与Micro进行Amyloid-beta、pTau两个指标的回归分析,即得到4类差异基因。如下图所示在Astro中的两类差异基因火山图。从右侧的韦恩图可以得到有208个基因表达与Amyloid-beta、pTau正相关等信息。
-
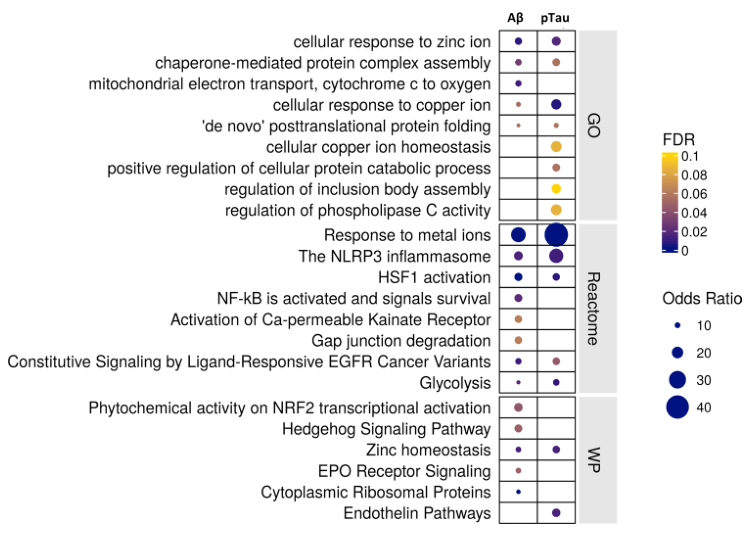
继续以Astro差异基因为例。文章将Amyloid-beta、pTau两个指标的回归差异基因进行通路富集分析(GO/Reactome/Wikipathways),得出结论:Increased expression of genes related to metal ion homeostasis, proteostasis, and inflammation in astrocytes with AD pathology。同法,也对Micro差异基因结果进行类似的分析。
4、细胞通讯分析
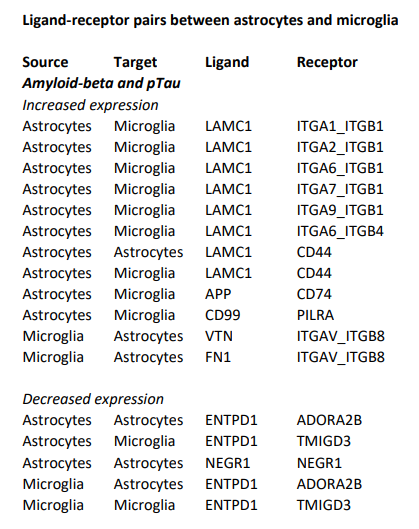
- 使用CellChat包对Astro与Micro进行ligand–receptor的细胞间通讯分析。
- 根据配受体基因与Amyloid-beta、pTau两个指标的相关性,将CellChat结果分为3类:(1)Amyloid-beta and pTau;(2)Amyloid-beta only;(3)pTau only
- 如下图是Amyloid-beta and pTau的结果,可结合配受体对的功能展开分析与讨论。
5、共表达网络分析
-
文章使用MEGENA进行共表达网络分析,计算得到astrocytes与microglia分别在EC与SSC的module;使用SCENIC进行转录因子分析,也分别得到astrocytes与microglia分别在EC与SSC的regulons。
-
然后使用AUCell包计算出每个细胞核的对应细胞类型模块的score。然后结合Aβ/pTau指标进行类似上述差异基因的回归分析。即Aβ/pTau指标变化与模块表达score是否存在相关性。根据分析结果,初步得到结论:The EC and SSC show similar co‑expression signatures。如下图展示部分module与regulon


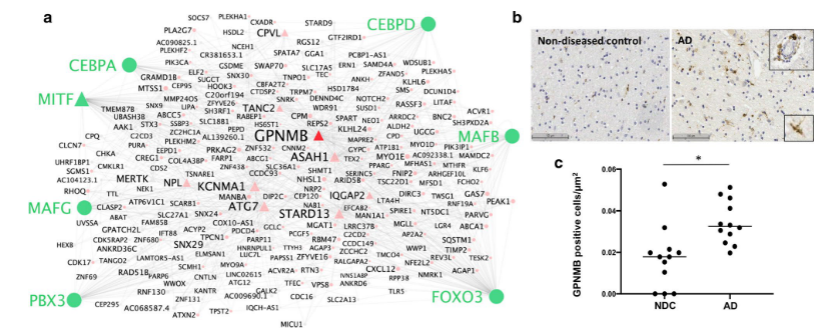
- 根据上述得到的基因模块表达特征与功能特征,分析AD GWAS基因所发挥的cell-specific功能。例如下图所示:GPNMB已知是AD的biomarker,它是Micro的amyloid-beta and pTau 正相关模块(module11)的hub gene;而且该基因在AD的Micro中也是相对高表达。
6、亚群特征分析
-
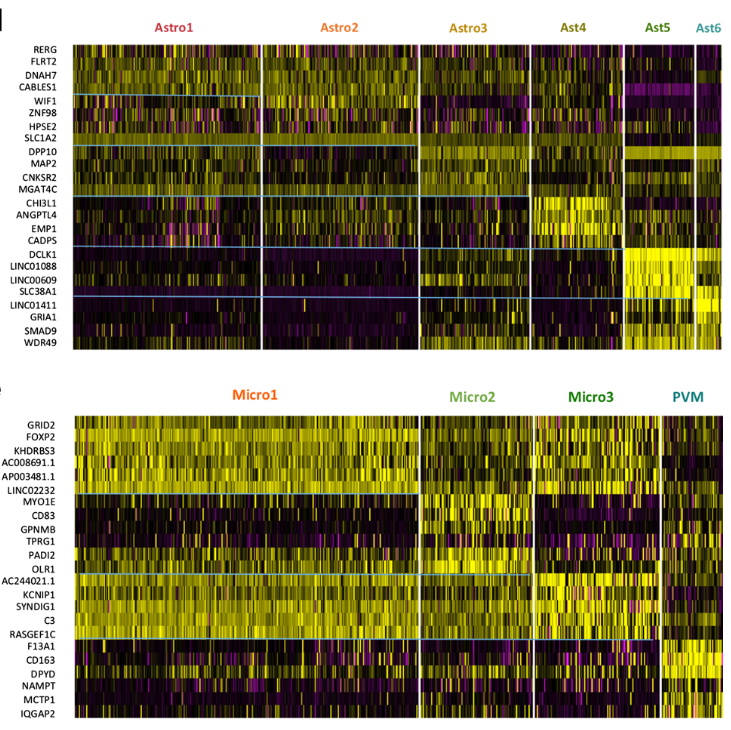
根据之前的细胞类型注释,将Astro与Micro进行在亚群分析。
-
在亚群分析时,主要结合细胞亚群的marker基因功能,是否为上述的差异基因;亚群熷细胞是否特异表达/参与上述计算得到的module/regulon等,具体可参看原文献。
我的想法:这篇单细胞文章测序样本量大,且有创新之处,即富集的Astro与Micro。而且计算差异基因方式很有新意,即进行病理指标的回归,也许更可以反映出基因表达水平与AD病理特征的关系。文章也使用多种多样的单细胞数据分析手段,例如亚群分析、细胞通讯分析、转录因子分析。总之无论是测序数据还是分析方法,都挺有借鉴价值的。